
3.2 反应活性
3.2.1 基质结构的影响
(1)定位效应
在按SNAr2历程进行的芳香族亲核取代反应里,吸电子基团引导进入基团定位在邻位和对位。相似地,在Ar-X中,CF3,Cl,Br,I,SMe等主要是对位定位,NH2和O-是间位定位。
但是在绝大多数地芳香族亲核取代反应中,在分子中只有一个即将离去的离去基团,因而研究的注意力并不主要集中在定位效应上。
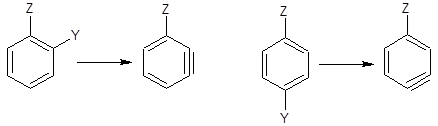
在通过苯炔中间体进行的反应中,有两个因素影响进入基团的位置。首先是苯炔生成的方向。当取代基在离去基团的邻位或对位时没有选择:
但是,有一个间位基团时,则苯炔可以通过两个不同的途径形成:
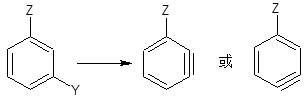
在这种情况下,总是脱掉酸性比较强的氢。
第二个因素是形成的苯炔有两个位置可以被进攻。有利于亲核试剂进攻的位置是导致形成比较稳定的碳负离子中间体的位置。
(2)反应活性
吸电子取代基对按SNAr2历程进行的反应有致活作用,特别是在即将离去的基团的邻位和对位的吸电子取代基的致和作用更大,而给电子取代基则有致钝作用。这种情况和在芳香族亲电取代反应里的恰好相反。
芳香环里的杂氮原子也有强的致活作用,成为季胺离子后,作用更大。研究SNAr2历程最常使用的基团是硝基。苯环没有活化基团,不适用于研究SNAr2历程。
3.2.2 离去基团的效应
在芳香族亲核取代反应中,不仅卤素、硫酸根、磺酸基、NR3+可以作为离去基团,而且NO2、OR、OAr、SO2R和SR等也可以作为离去基团。尤其是,硝基是一个特别好的离去基团。离去基团的活泼性顺序可以大致排列为:F>NO2>OTs>SOPh>Cl,Br,I>N3>NR3+>OAr,OR,SR,SO2R,NH2。但是,这种次序主要还要看亲核试剂的性质。在卤素中,氟是比较好的离去基团。其它的卤素活性都很接近,它们的次序一般是Cl>Br>I,但并非永远如此。在SNAr2历程中的离去基团的次序和在SN1历程和SN2历程中的很不相同。这种情况似乎是由于SNAr2历程的第一步反应通常是速率决定步骤,而这步反应被强的吸电子的(具有强的—I效应的)基团所促进的,因而,在SNAr2历程里,-I效应很强的基团(如Cl和NO2)比较容易被置换。另外一种解释是说氟是在卤素中唯一容易形成氢键的,它和亲核试剂形成氢键,因而是一个比较好的离去基团。自然,只有在亲核试剂中有氢时才有这种可能。在反应的第二步是速度决定步骤的SNAr2历程中,和在苯炔历程中,氟是卤素中最坏的离去基团。SN1历程中,只有N2+是重要的离去基团。
3.2.3 进攻的亲核试剂的效应
不同的作用物和不同的反应条件将导致不同的亲核性次序,因而不可能建立一个不变的亲核性次序,但是一个总的大致次序是:NH2->Ph3C->PhNH—(芳香炔历程)>ArS->RO->R2NH>ArO->OH->ArNH2>NH3>I->Br->Cl->H2O>ROH。和脂肪族亲核取代反应一样,亲核性和碱性强度有关。当进攻的原子是周期表中同族的原子时,它们的亲核性依据它们在周期表中的位置由上而下的顺序递增。但是,也有例外;例如:OH-的碱性比ArO-的强,但是它是一个比较差的亲核试剂。在一系列相似的亲核试剂(如取代苯胺)中,亲核性是和碱性相互关联的。奇怪的是除个别情况外,氰负离子不能作为亲核试剂取代在芳香体系上。
4 说明
本文由参考文献1-2相关章节缩写而成。
参考文献
[1] [美] J.马奇着陶慎熹赵景旻译《高等有机化学》,人民教育出版社,1982.
[2] 高振衡编《物理有机化学》,高等教育出版社,1983.




